a) T1=3243.24 K
b) Wderecha=-9301.61 J
c) Q=69199.99 J
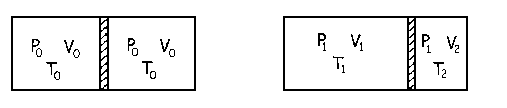
a) Al final tenemos que se ha establecido el equilibrio, luego las dos partes del cilindro están a la misma presión de 7.29 atm. Además la temperatura inicial es de 0ºC:
T0=0ºC=273 K
Para los calores específicos tendremos que:
cP-cV=R ⇒ cV=cP-R=4-2=2 cal/molK
Y el cociente entre las capacidades térmicas:
![]()
En el gas de la derecha no hay intercambio de calor. La transformación es adiabática y deberá cumplirse que:
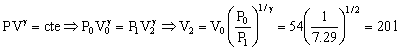
Podemos así determinar el volumen final del gas de la izquierda. Inicialmente cada uno de los dos compartimentos tiene 54 l luego el volumen total del recipiente es:
VT=2V0=2·54=108 l
Y al final como el compartimento de la derecha tiene 20 l el de la izquierda tendrá el resto luego:
V1=VT-V2=108-20=88 l
Como se trata de un gas perfecto:
![]()
T1=3243.24 K
b) El trabajo realizado para comprimir el gas de la derecha será el necesario para comprimir un gas adiabáticamente:
![]()
Wderecha=-9301.61 J
c) El trabajo Wderecha lo ha realizado el gas que se expande en la parte izquierda, por lo que:
Wizquierda=-Wderecha=9301.61 J
Por otro lado la variación de energía interna en el gas de la izquierda será:
ΔU=ncVΔT=ncV(T1-T0)
El número de moles lo podemos obtener de la ecuación de los gases perfectos:
![]()
Y sustituyendo:
ΔU=ncV(T1-T0)=2.412·2(3243.24-273)=14329.76 cal=59898.38 J
Y a través del primer principio de la Termodinámica:
Q=ΔU+W=59898.38+9301.61=69199.99 J
Q=69199.99 J