a) 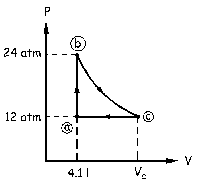
b) ΔQab=3000 cal; ΔWab=0; ΔUab=3000 cal; ΔUbc=0; ΔWbc=1653.33 cal; ΔQbc=1653.33 cal; ΔQca=-4200 cal; ΔWca=-1192.63 cal; ΔUca=-3007.37 cal
c) ΔU=0; ΔQ=453.33 cal; ΔW=460.07 cal
 a) El ciclo se inicia en el punto que denominaremos a. En este punto conocemos la presión, 12 atm, y el volumen, 4.1 l. Desde aquí se calienta el gas a volumen constante, es decir, tendremos que dibujar una recta paralela al eje de presiones hasta el punto b, en el cual el volumen es el mismo que en a, y la presión el doble:
a) El ciclo se inicia en el punto que denominaremos a. En este punto conocemos la presión, 12 atm, y el volumen, 4.1 l. Desde aquí se calienta el gas a volumen constante, es decir, tendremos que dibujar una recta paralela al eje de presiones hasta el punto b, en el cual el volumen es el mismo que en a, y la presión el doble:
Pb=2Pa=2 · 12=24 atm
Después se expande el gas isotérmicamente, luego dibujaremos una línea curva hasta el punto c, en el cual la presión es la misma que la inicial, es decir, 12 atm, y el volumen es desconocido.
Por último se realiza una compresión a presión constante, luego dibujaremos una recta paralela al eje de volúmenes hasta las condiciones iniciales, es decir, de nuevo hasta el punto a. Tendremos pues el gráfico de la figura.
b) Determinaremos en primer lugar el calor específico a presión constante, teniendo en cuenta que:
cP=cV+R=5+2=7 cal/molK
La transformación a — b es a volumen constante luego el calor intercambiado es:
ΔQab=ncVΔTab=ncV(Tb-Ta)
El número de moles podemos calcularlo aplicando la ecuación de los gases perfectos al estado a, sabiendo que la temperatura en este punto es:
Ta=27ºC=300 K
Entonces:
![]()
Ahora nos falta la temperatura en el punto b. Como la transformación es a volumen constante se cumplirá que:
![]()
El calor intercambiado en esta transformación es pues:
ΔQab=ncV(Tb-Ta)=2·5(600-300)=3000 cal
ΔQab=3000 cal
Por ser a volumen constante el trabajo realizado es nulo:
ΔWab=0
Y la variación de energía interna la determinamos por el primer principio de la Termodinámica:
ΔQab=ΔWab+ΔUab ⇒ ΔUab=ΔQab-ΔWab=ΔQab=3000 cal
ΔUab=3000 cal
La transformación b — c es isoterma luego la variación de energía interna es nula:
ΔUbc=0
El trabajo realizado es:
![]()
Por la ecuación de los gases perfectos:
PbVb=nRTb
Luego nos queda:
![]()
Y nos falta determinar el volumen en el punto c. Como la transformación es isoterma se cumple:
![]()
El trabajo entonces en esta transformación es:
![]()
![]()
ΔWbc=1653.33 cal
Y la variación de calor la determinamos a través del primer principio de la Termodinámica:
ΔQbc=ΔUbc+ΔWbc=ΔWbc=1653.33 cal
ΔQbc=1653.33 cal
La transformación c — a es isobara (a presión constante) luego el calor intercambiado es:
ΔQca=ncPΔTca=ncP(Ta-Tc)=2 · 7(300-600)=-4200 cal
ΔQca=-4200 cal
El trabajo realizado:
ΔWca=PaΔVca=Pa(Va-Vc)=12(4.1-8.2)=-49.2 atm · l=
![]()
ΔWca=-1192.63 cal
Y por el primer principio de la Termodinámica:
ΔQca=ΔUca+ΔWca ⇒ ΔUca=ΔQca-ΔWca=-4200+1192.63=-3007.37 cal
ΔUca=-3007.37 cal
c) Para todo el ciclo tendremos la variación de energía interna debe ser nula. Podemos comprobar que es prácticamente cierto:
ΔU=ΔUab+ΔUbc+ΔUca=3000+0-3007.37=-7.37 cal≈0
ΔU=0
La variación de calor:
ΔQ=ΔQab+ΔQbc+ΔQca=3000+1653.33-4200=453.33 cal
ΔQ=453.33 cal
Y la variación de trabajo:
ΔW=ΔWab+ΔWbc+ΔWca=0+1653.33-1192.63=460.07 cal
ΔW=460.07 cal
Podríamos haberlo determinado también mediante la aplicación del primer principio de la Termodinámica:
ΔQ=ΔU+ΔW=ΔW=453.33 cal