QGH=1225 kcal
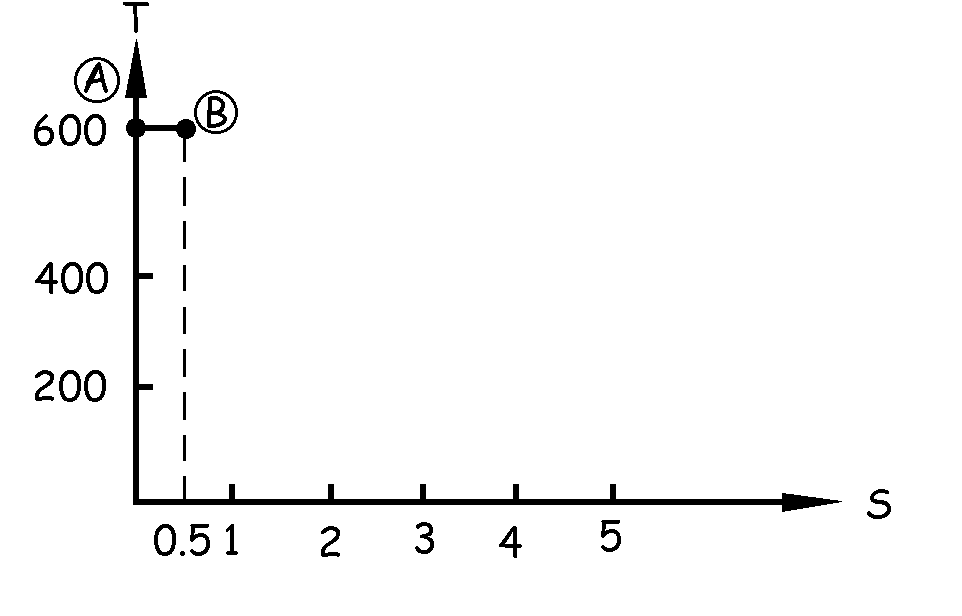 Vamos a ver la variación de entropía correspondiente a cada una de las transformaciones. Además, iremos dibujando estas transformaciones en un diagrama S-T. En primer lugar el sistema va de A a B por vía isoterma a 600 K, absorbiendo 300 kcal. En el diagrama S-T tendremos una recta paralela al eje de entropías. La variación de entropía es:
Vamos a ver la variación de entropía correspondiente a cada una de las transformaciones. Además, iremos dibujando estas transformaciones en un diagrama S-T. En primer lugar el sistema va de A a B por vía isoterma a 600 K, absorbiendo 300 kcal. En el diagrama S-T tendremos una recta paralela al eje de entropías. La variación de entropía es:
![]()
Por tanto sabemos además que la recta AB debe medir 0.5 unidades en el eje horizontal.
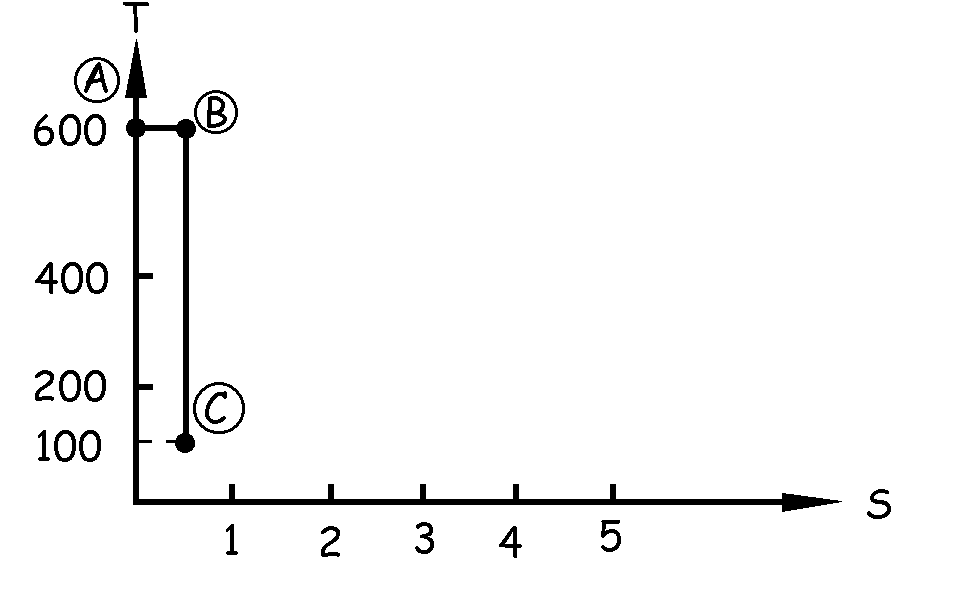 Desde B hasta C tenemos un proceso adiabático hasta los 100 K. Por ser el proceso adiabático no existe variación de calor, luego tampoco hay variación de entropía. La entropía permanece constante, por lo que en la gráfica tendremos una recta vertical siempre a la altura de 0.5 kcal/K (dato obtenido en la transformación anterior) en el eje horizontal, y que irá desde la temperatura de 600 K hasta la temperatura de 100 K.
Desde B hasta C tenemos un proceso adiabático hasta los 100 K. Por ser el proceso adiabático no existe variación de calor, luego tampoco hay variación de entropía. La entropía permanece constante, por lo que en la gráfica tendremos una recta vertical siempre a la altura de 0.5 kcal/K (dato obtenido en la transformación anterior) en el eje horizontal, y que irá desde la temperatura de 600 K hasta la temperatura de 100 K.
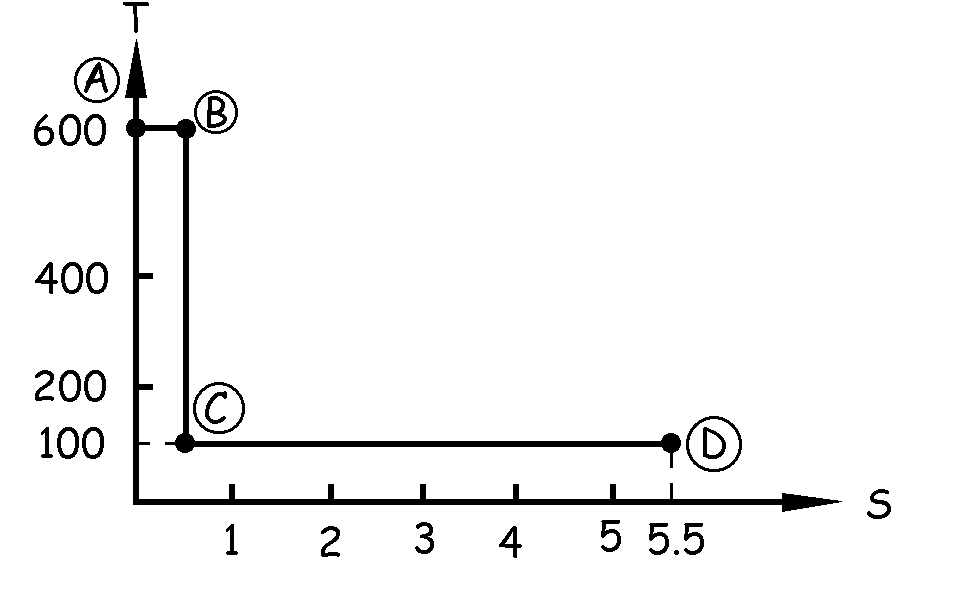 Desde C hasta D tenemos otra transformación isoterma a 100 K con absorción de 500 kcal. La variación de entropía en este caso es:
Desde C hasta D tenemos otra transformación isoterma a 100 K con absorción de 500 kcal. La variación de entropía en este caso es:
![]()
En el gráfico S-T tendremos que dibujar una horizontal a la altura de 100 K, ya que la tempertura es constante.
 Como la variación de entropía es de 5 kcal/K la longitud de esta horizontal debe ser de 5 unidades, luego teniendo en cuenta que empieza en el punto C, de abscisa 0.5, llegará hasta 5.5 kcal/K.
Como la variación de entropía es de 5 kcal/K la longitud de esta horizontal debe ser de 5 unidades, luego teniendo en cuenta que empieza en el punto C, de abscisa 0.5, llegará hasta 5.5 kcal/K.
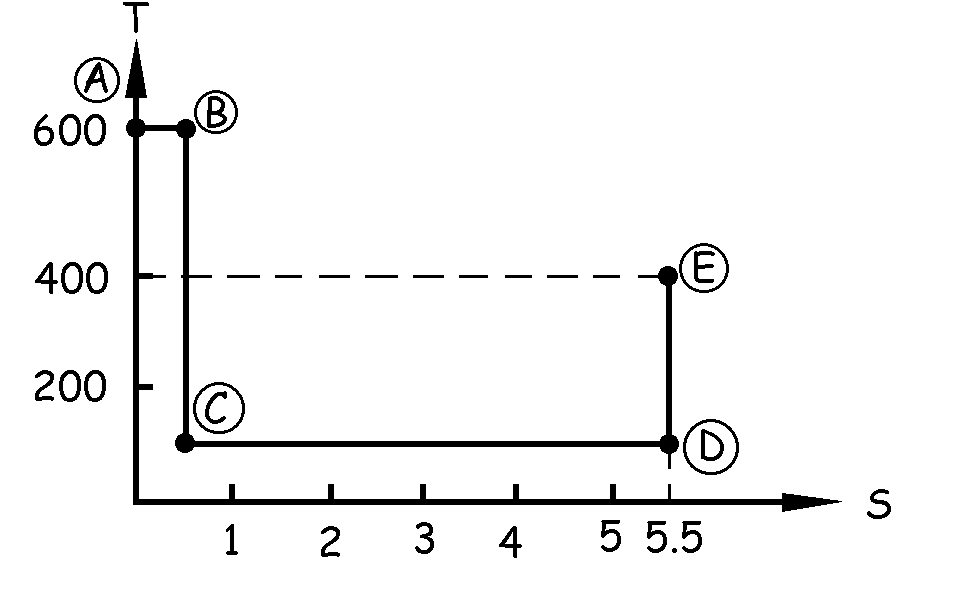
La transformación DE es adiabática. Por las mismas razones que explicamos en la transformación BC la variación de entropía es nula. Habrá que dibujar en el gráfico una vertical, ya que la entropía permanece constante, que debe llegar hasta la altura de 400 K.
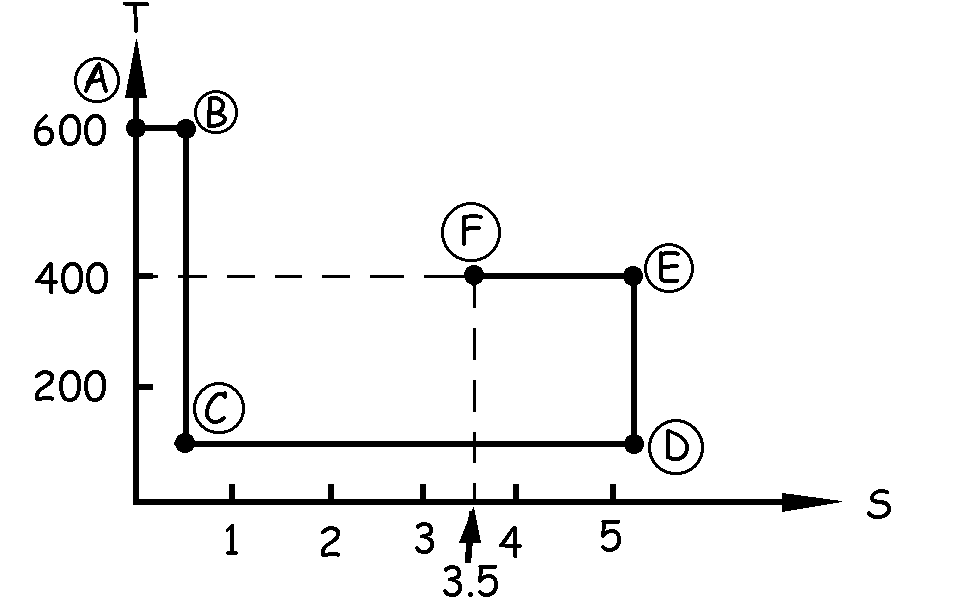 Desde E hasta F tenemos otra transformación isoterma con cesión de 800 kcal. La variación de entropía será negativa y valdrá:
Desde E hasta F tenemos otra transformación isoterma con cesión de 800 kcal. La variación de entropía será negativa y valdrá:
![]()
Este tramo vendría representado en el gráfico por una horizontal a la altura de 400 K, porque la temperatura es constante. La longitud de esta recta es de 2 unidades, y tendremos que contarlas en sentido negativo, por lo que si estábamos en el punto de valor 5.5 kcal/K acabaremos en el punto de abscisa 3.5 kcal/K.
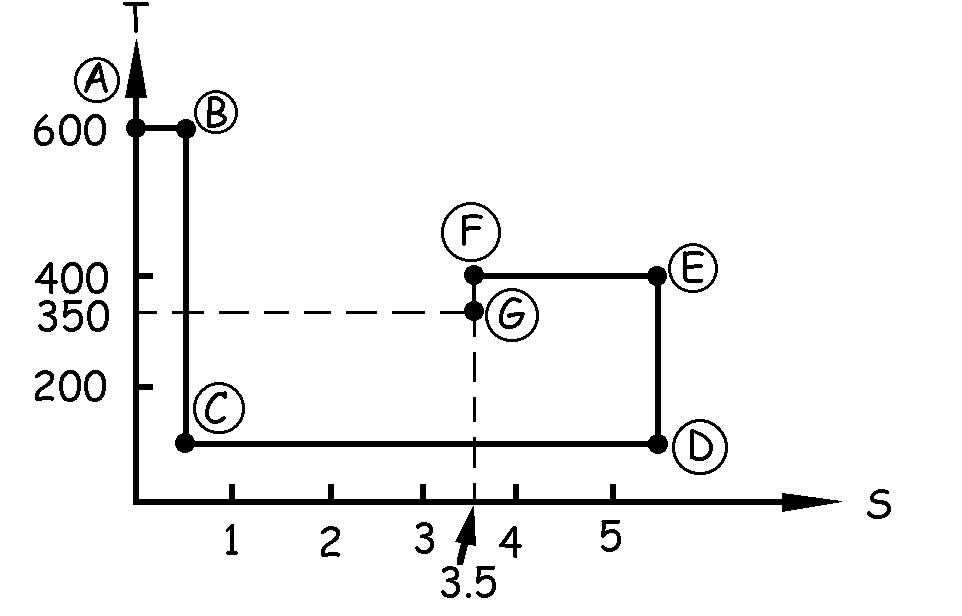 Por tanto la variación total de entropía en el proceso es:
Por tanto la variación total de entropía en el proceso es:
ΔS=ΔSAB+ΔSCD+ΔSEF=0.5+5-2=3.5 kcal/K
Se desea volver ahora al estado inicial cediendo calor por vía isoterma a 350 K. Podemos pasar desde F hasta G por vía adiabática, de modo que no existiría variación de calor, hasta la temperatura de 350 K. Tendríamos que poner entonces en la gráfica una línea vertical (variación de entropía nula) que iría desde la temperatura de 400 K hasta la de 350 K.
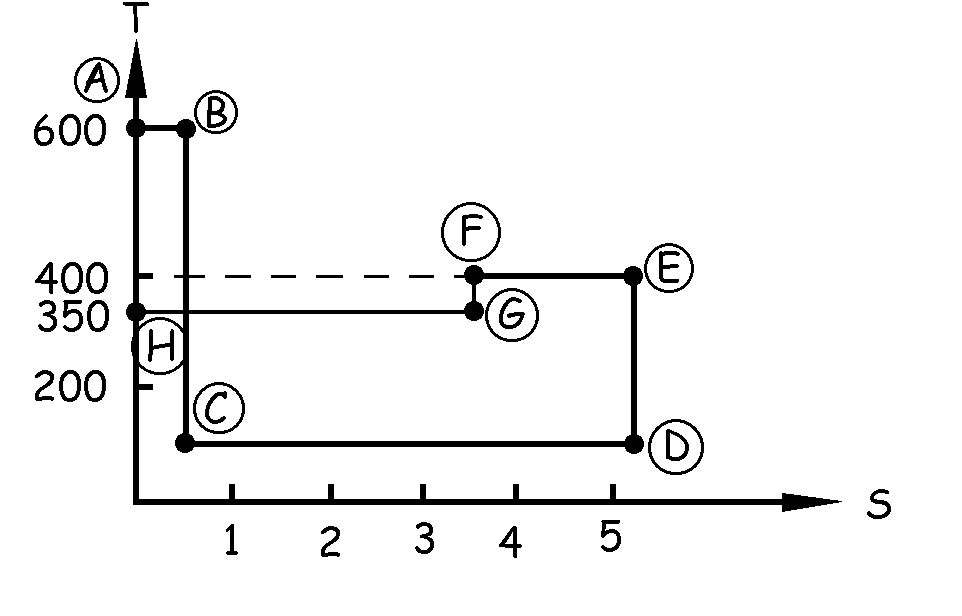 A continuación tendremos que pasar mediante una isoterma (horizontal a la altura de 350 K) hasta las condiciones iniciales, es decir, la entropía deberá variar exactamente lo mismo, ya que es una función de estado:
A continuación tendremos que pasar mediante una isoterma (horizontal a la altura de 350 K) hasta las condiciones iniciales, es decir, la entropía deberá variar exactamente lo mismo, ya que es una función de estado:
![]()
QGH=ΔSGH · TGH=3.5 · 350=1225 kcal
QGH=1225 kcal