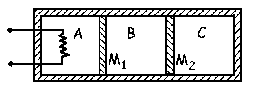
TA=983.89 K; TB=TC=360 K; VA=43.19 l; VB=VC=15.80 l; PA=PB=PC=1.893·105 N/m2; Q=16801.3 J
Tenemos como datos las condiciones iniciales en los tres compartimentos:
P0A=P0B=P0C=P0=105 N/m2=0.987 atm; T0A=T0B=T0C=T0=300 K; nA=nB=nC=n=1 mol
Como inicialmente la presión, la temperatura y el número de moles son iguales en los tres compartimentos, también serán iguales los tres volúmenes.
V0A=V0B=V0C=V0
Podemos determinar por tanto el volumen inicial en uno cualquiera de los tres compartimentos. Aplicando la ecuación de los gases perfectos:
![]()
Los tres pistones deslizan sin rozamiento, luego siempre las presiones finales serán iguales en los tres compartimentos:
PA=PB=PC
Como el pistón M2 es diatérmico, la temperatura final de los compartimentos B y C será la misma:
TB=TC=360 K
TB=360 K
TC=360 K
En los compartimentos B y C tenemos la misma presión, el mismo número de moles y la misma temperatura, luego tendremos también el mismo volumen:
VB=VC
Además el pistón M1 es adiabático, luego en el compartimento B+C la transformación es adiabática. Podemos considerar un único compartimento de volumen VB+VC=2VC a temperatura TC que experimenta una transformación adiabática, luego:
TVγ-1=cte
Determinamos los calores específicos y el coeficiente adiabático. Por ser gases ideales diatómicos:
![]()
Y sabemos que:
CP-CV=R ⇒ CP=R+CV=2+5=7 cal/molK
Por tanto el coeficiente adiabático es:
![]()
Tendremos entonces que para el compartimento B+C:
TVγ-1=cte
![]()
VC=15.80 l
Y entonces:
VB=VC=15.80 l
VB=15.80 l
El volumen total de los compartimentos A, B y C no cambia, y vale 3V0. Por tanto para el volumen del compartimento A después de la transformación tendremos:
3V0=VA+VB+VC ⇒ VA=3V0-VB-VC=3·24.93-15.80-15.80=43.19 l
VA=43.19 l
En el compartimento B conocemos el volumen, la temperatura y el número de moles, luego podemos determinar la presión a través de la ecuación de los gases perfectos:
![]()
PB=1.893·105 N/m2
Las presiones finales en los tres compartimentos son iguales, luego:
PA=1.893·105 N/m2
PC=1.893·105 N/m2
Nos falta únicamente la temperatura en el compartimento A, donde conocemos presión, volumen y número de moles. A partir de la ecuación de los gases perfectos:
![]()
TA=983.89 K
El sistema total (A+B+C) tiene volumen constante. Para una transformación isocora el trabajo realizado es nulo:
W=0
Por el primer principio de la termodinámica:
U=Q-W=Q
Por tanto el calor suministrado al sistema en este caso tiene que coincidir con la variación de energía interna:
Q=U=UA+UB+UC
Si tomamos el compartimento B+C la transformación es adiabática, luego:
QB+C=0
A través del primer principio de la Termodinámica:
UB+C=QB+C-WB+C=-WB+C=-2nCV(T0-TC)=-2 · 1 · 5(300-360)=600 cal=2508 J
Y para el compartimento A:
UA=nCV(TA-T0)=1 · 5(983.89-300)=3419.45 cal=14293.3 J
Entonces:
Q=UA+UB+UC=UA+UB+C=14293.3+2508=16801.3 J
Q=16801.3 J