a) 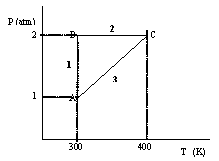
b) PA=1 atm, VA=49.2 l, TA=300 K ; PB=2 atm, VB=24.6 l, TB=300 K; PC=2 atm, VC=32.8 l, TC=400 K
c) ΔU1=0, ΔU2=2946 J, ΔU3=-2946 J, ΔS1=-11.53 J/K, ΔS2=11.96 J/K, ΔS3=-0.43 J/K
d) T=350 K
Problema de Entropia y Segundo Principio de la Termodinámica
Aparece en la convocatoria JUN2009
Dos moles de un gas ideal monoatómico inicialmente a 1 atm y 300 K realizan el siguiente ciclo, cuyas etapas son todas reversibles: 1) Compresión isotérmica hasta 2 atm, 2) Aumento isobárico de la T hasta 400K y 3) Retorno al estado inicial por el camino P=a+bT, siendo a y b constantes.
a) Dibuja esquemáticamente el ciclo sobre un diagrama P-T.
b) Calcula P, V y T de cada uno de los estados.
c) Calcula las variaciones numéricas ΔU y ΔS para cada etapa del ciclo.
d) En algún punto del último proceso la presión vale 1.5 atm ¿Cuánto vale entonces la temperatura?
(Cv para un gas ideal monoatómico = 3/2 R).