h=22.386 cm; T´=394.95 K; ΔU=254.88 J; Q=356.83 J
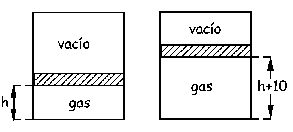
El gas de la parte inferior de la figura se encuentra a presión constante, que es:
![]()
Con esto podemos calcular el volumen inicialmente ocupado por este gas, aplicando la ecuación de los gases perfectos:
![]()
El volumen que ocupa será igual al área de la base por la altura. Como conocemos el área de la base, que es el del pistón (50 cm2) podemos determinar la altura h inicial:
![]()
h=22.386 cm
Con lo cual después la nueva altura es:
h´=h+10=22.386+10=32.386 cm
Y el nuevo volumen:
V´=Sh´=50·32.386=1619.3 cm3
El gas se expansiona a presión constante luego se verifica:
![]()
T´=394.95 K
Y la variación de energía interna es:
ΔU=ncVΔT=ncV(T´-T)=0.1·5(394.95-273)=60.975 cal=254.88 J
ΔU=254.88 J
Y para el calor suministrado al sistema aplicamos el primer principio de la termodinámica:
ΔQ=ΔU+W
Como la expansión se reliza a presión constante: W=PΔV=nRΔT
ΔQ=ncVΔT+nRΔT=n(cV+R)ΔT=ncPΔT
cP=cV+R=5+2=7 cal/molK
Nos queda:
Q=ncPΔT=ncP(T´-T)=0.1·7(394.95-273)=85.365 cal=356.83 J
Q=356.83 J