a) V2d=2.28 l; V2i=7.72 l; T2d=410.4 K; T2i=1389.6 K
b) ΔQi=4731.86 J
c) ΔSi=6.73 J/K
a) Marcaremos con el subíndice 1 a las condiciones iniciales, y con el subíndice 2 a las condiciones finales. Inicialmente tenemos que las condiciones son las mismas en los dos compartimentos:
P1d=P1i=P1=71 cm de Hg=710 mm de Hg=0.934 atm
V1d=V1i=V1=5 l; T1i=T1d=T1=27ºC=300 K
Y al final conocemos únicamente la presión, que se ha triplicado:
P2d=P2i=P2=3P1=3 · 0.934=2.802 atm
Además, como son gases ideales biatómicos conocemos el coeficiente adiabático:
γ=1.4
El compartimento de la derecha sufre una transformación adiabática, luego en él:
![]()
V2d=2.28 l
Como sabemos que el volumen total del compartimento es de 10 l:
V=V2i+V2d ⇒ V2i=V-V2d=10-2.28=7.72 l
V2i=7.72 l
Como el gas de la derecha es un gas ideal debe verificarse que:
![]()
T2d=410.4 K
Y lo mismo debe verificarse para el compartimento de la izquierda, ya que también es un gas ideal:
![]()
T2i=1389.6 K
b) Aplicamos el primer principio de la Termodinámica al gas de la izquierda:
ΔQi=ΔUi+ΔWi
La variación de energía interna será, si suponemos que tanto R, como cP y cV están en atm· l/molK:
ΔUi=ncVΔTi=ncV(T2i-T1)
Sabemos que por ser un gas ideal se cumplen las expresiones:
cP-cV=R
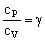
De la segunda expresión:
![]()
Y sustituyendo en la primera:
cP-cV=R ⇒ γcV-cV=R ⇒ ![]()
Por tanto si sustituimos esto en la expresión que nos da la variación de energía interna:
![]()
Y teniendo en cuenta la ecuación de los gases perfectos:
![]()
Sustituyendo en la expresión de la energía interna:
![]()
![]()
![]()
El volumen del recipiente es constante, lo que quiere decir que el trabajo exterior del sistema es nulo, es decir, que el trabajo realizado por el gas de la izquierda sobre el de la derecha será igual y de signo contrario al que realiza éste:
![]()
![]()
Y el trabajo que nos interesa:
ΔWi=-ΔWd=435.33 J
A través del primer principio:
ΔQi=ΔUi+ΔWi=4296.53+435.33=4731.86 J
ΔQi=4731.86 J
c) La variación de entropía del gas de la derecha es nula ya que es una transformación adiabática:
ΔSd=0
El gas de la izquierda modifica su presión y su temperatura luego:
![]()
Sustituimos cV por su valor y nos queda:
![]()
Y teniendo en cuenta como antes que a través de la ecuación de los gases perfectos:
![]()
Nos queda entonces:
![]()
![]()
![]()
ΔSi=6.73 J/K