Qab=2560.98 J; Qbc=2143.88 J; Qcedido=4401.18 J
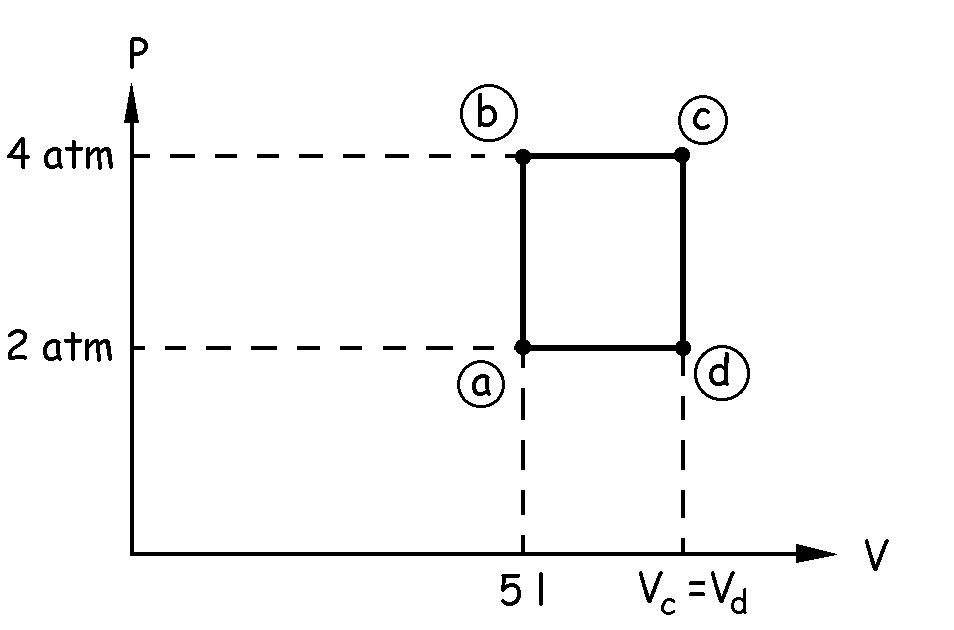 Si trazamos un diagrama P-V tendremos lo que aparece en el diagrama. El ciclo comienza en el punto a, donde tenemos un volumen de 5 l y una presión de 2 atm. A continuación el gas se calienta a volumen constante, luego tendremos una vertical, paralela al eje de presiones, hasta lograr con el mismo volumen una presión de 4 atm, punto representado como el b. Después, a presión constante se calienta el gas hasta la temperatura de 650 K, luego tendremos que trazar una paralela al eje de volúmenes hasta el punto c. Posteriormente, se enfría el gas a volumen constante, llegando al punto d en el que la presión es la inicial, es decir, de 2 atm. Por último, a presión constante se vuelve de nuevo a las coordenadas del punto a.
Si trazamos un diagrama P-V tendremos lo que aparece en el diagrama. El ciclo comienza en el punto a, donde tenemos un volumen de 5 l y una presión de 2 atm. A continuación el gas se calienta a volumen constante, luego tendremos una vertical, paralela al eje de presiones, hasta lograr con el mismo volumen una presión de 4 atm, punto representado como el b. Después, a presión constante se calienta el gas hasta la temperatura de 650 K, luego tendremos que trazar una paralela al eje de volúmenes hasta el punto c. Posteriormente, se enfría el gas a volumen constante, llegando al punto d en el que la presión es la inicial, es decir, de 2 atm. Por último, a presión constante se vuelve de nuevo a las coordenadas del punto a.
El número de moles de gas que tenemos lo podemos determinar con la ecuación de los gases perfectos, que aplicaremos al punto a:
![]()
La transformación desde a hasta b es a volumen constante luego se debe cumplir que:
![]()
Luego el calor absorbido en la transformación a — b, teniendo en cuenta que es a volumen constante y que el calor específico viene dado en J/molK, es:
Qab=ncVΔTab=ncV(Tb-Ta)=0.4878 · 21(500-250)=2560.98 J
Qab=2560.98 J
La transformación b — c es a presión constante luego se cumple:
![]()
El calor específico a presión constante será:
cP-cV=R ⇒ cP=R+cV=8.3+21=29.3 J/molK
Por tanto el calor en esta transformación es:
Qbc=ncPΔTbc=ncP(Tc-Tb)=0.4878 · 29.3(650-500)=2143.88 J
Qbc=2143.88 J
Ahora tenemos que determinar el calor cedido durante el ciclo. Los calores utilizados en las transformaciones ab y bc son positivos, luego son calores absorbidos. Vamos a determinar los calores que se producen en las transformaciones c — d y d — a, para ver si son calores absorbidos o cedidos.
La transformación desde c hasta d es a volumen constante luego se cumple:
![]()
Y el calor necesario para esta transformación:
Qcd=ncVΔTcd=ncV(Td-Tc)=0.4878 · 21(325-650)=-3329.24 J
Y para el último proceso, desde d hasta a, la transformación se realiza a presión constante luego tendremos:
Qda=ncPΔTda=ncP(Ta-Td)=0.4878 · 29.3(250-325)=-1071.94 J
Estos dos calores son negativos luego son cedidos. El calor cedido durante el ciclo será:
Qcedido=Qcd+Qda=3329.24+1071.94=4401.18 J
Qcedido=4401.18 J