DS=4.5 cal/K
Llamaremos V1 y V2 a los volúmenes de ambos recipientes, de modo que cuando ambos se ponen en comunicación el volumen final es:
V=V1+V2
Para el gas 1 la variación de entropía es:
![]()
La transformación se realiza a temperatura constante luego:
![]()
Por tanto:
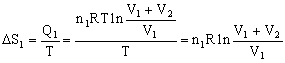
Teniendo en cuenta que tenemos un gas perfecto en cualquiera de los dos recipientes:
![]()
![]()
Sustituyendo en la expresión que teníamos:

Si hacemos exactamente el mismo desarrollo para el gas que ocupa el segundo recipiente, siguiendo los mismos pasos llegaríamos a:
![]()
La variación de entropía experimentada por el sistema es:
D
S=D
S1+D
S2=2.77+1.73=4.5 cal/K
D
S=4.5 cal/K