a) P1=1 atm; T1=288 K; V1=815.89 l; P2=30 atm; V2=71.87 l; T2=761.07 K; P3=30 atm; T3=1961.07 K; V3=185.19 l; V4=815.89 l; P4=3.76 atm; T4=1082.86 K
b) η=0.506
a) En primer lugar vamos a dibujar el diagrama P-V. Conocemos presión y temperatura en el punto 1.
P1=76 cm de Hg=1 atm
P1=1 atm
T1=15ºC=288 K
T1=288 K
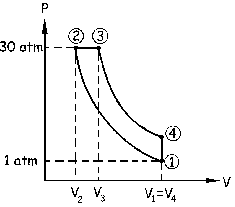 Tenemos por tanto las coordenadas del punto inicial. A partir de este punto se comprime el gas adiabáticamente hasta una presión de 30 atm, luego tendremos que trazar una curva hasta el punto que denominaremos 2. A continuación se calienta el gas a presión constante, luego dibujamos una recta paralela al eje de volúmenes hasta el punto 3. Después se expande el gas adiabáticamente hasta llegar al volumen inicial, luego tendremos que dibujar una curva que termine en un punto 4 situado encima del punto 1 (iguales volúmenes). Por último se realiza una transformación isócora (volumen constante) para llegar a las condiciones iniciales, luego trazaremos una recta paralela al eje de presiones que termine en el punto 1. Tenemos pues el diagrama de la figura.
Tenemos por tanto las coordenadas del punto inicial. A partir de este punto se comprime el gas adiabáticamente hasta una presión de 30 atm, luego tendremos que trazar una curva hasta el punto que denominaremos 2. A continuación se calienta el gas a presión constante, luego dibujamos una recta paralela al eje de volúmenes hasta el punto 3. Después se expande el gas adiabáticamente hasta llegar al volumen inicial, luego tendremos que dibujar una curva que termine en un punto 4 situado encima del punto 1 (iguales volúmenes). Por último se realiza una transformación isócora (volumen constante) para llegar a las condiciones iniciales, luego trazaremos una recta paralela al eje de presiones que termine en el punto 1. Tenemos pues el diagrama de la figura.
En condiciones normales (1 atm de presión y 273 K) 1 l de aire pesa 1.293 g. La densidad entonces será de 1.293 g/l. El volumen ocupado por 1 kg de aire en estas condiciones es:
![]()
Para el punto 1 tendremos que el volumen ocupado será, teniendo en cuenta que la presión es constante (en condiciones normales y en las condiciones del punto 1 tenemos 1 atm):
![]()
V1=815.89 l
En el punto 2 nos dan la presión:
P2=30 atm
Del punto 1 al 2 tenemos una transformación adiabática, luego se cumplirá:
![]()
V2=71.87 l
Además por ser un gas ideal debe verificarse que:
![]()
T2=761.07 K
La transformación del punto 2 al 3 es a presión constante luego ya sabemos la presión en el punto 3:
P3=P2=30 atm
P3=30 atm
Además, sabemos que se han suministrado 300 kcal. El calor suministrado en una transformación a presión constante es:
![]()
T3=1961.07 K
Y por ser un gas perfecto y producirse la transformación a presión constante:
![]()
V3=185.19 l
Ahora la transformación de 3 a 4 es una expansión adiabática para llegar al volumen inicial luego:
V4=V1=815.89 l
V4=815.89 l
Como la transformación es adiabática:
![]()
P4=3.76 atm
Y por la ecuación de los gases perfectos:
![]()
T4=1082.86 K
b) El rendimiento del ciclo es:
![]()
El único calor cedido se suministra al ciclo en la transformación desde 2 hasta 3, en la que se comunican:
Qcedido=Q23=300 kcal=300000 cal=1254000 J
Ahora vamos a ver el trabajo realizado. En la transformación desde 1 hasta 2 tenemos una compresión adiabática luego:
![]()
![]()
En la transformación 2 — 3 se realiza un trabajo:
W23=P3(V3-V2)=30(185.19-71.87)=3399.6 atm · l=
![]()
Durante la transformación adiabática, es decir, desde 3 hasta 4, tendremos un trabajo:
![]()
![]()
En la transformación a volumen constante no ser realiza trabajo luego:
W41=0
El trabajo realizado durante todo el ciclo será entonces:
W=W12+W23+W34+W41=-339941+344463.52+630228+0=634750.52 J
Y el rendimiento del ciclo:
![]()
η=0.506