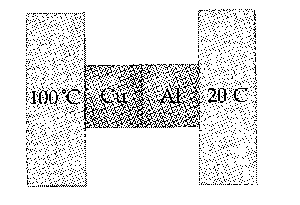
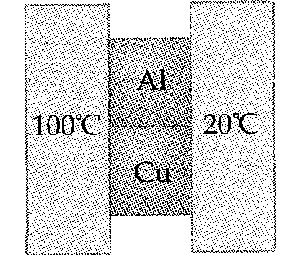
Problema de Calor y Primer Principio de la Termodinámica.
Cuestion de Calor y Primer Principio de la Termodinámica.
¿A qué temperatura se tiene el mismo valor en las escalas Farenheit y Celsius?
Problema de Calor y Primer Principio de la Termodinámica.
Problema de Calor y Primer Principio de la Termodinámica.
Problema de Calor y Primer Principio de la Termodinámica.
Problema de Calor y Primer Principio de la Termodinámica.
Problema de Calor y Primer Principio de la Termodinámica.
Problema de Calor y Primer Principio de la Termodinámica.